تصور کنید بتوانید با یک لیمو و چند وسیله ساده دیگر برق تولید کنید! باتری لیمویی یک آزمایش جذاب و آموزنده است که به شما امکان میدهد با استفاده از مواد معمولی، به دنیای شگفتانگیز الکتریسیته قدم بگذارید. این تجربه نه تنها سرگرمکننده است، بلکه اصول اولیه واکنشهای شیمیایی و تولید انرژی را نیز به صورت عملی به شما نشان میدهد. اگر به دنبال یک فعالیت علمی ساده و در عین حال هیجانانگیز هستید که برای همه سنین مناسب باشد، ساخت باتری لیمویی گزینهای عالی است. در این مقاله، نحوه ساخت این باتری و مفاهیم علمی پشت آن را با هم بررسی میکنیم.
چه چیزی باعث ایجاد برق می شود؟
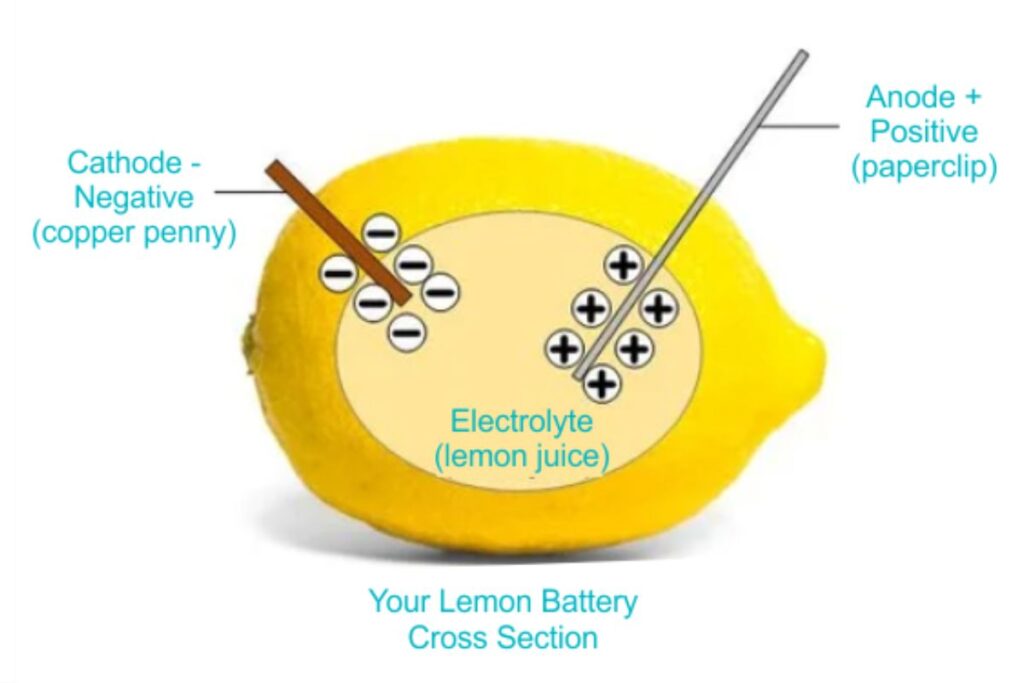
لیمو به دلیل داشتن اسید سیتریک، به عنوان یک الکترولیت عمل میکند و محیطی را فراهم میکند که یونها بتوانند در آن حرکت کنند. میخ گالوانیزه که حاوی روی است، به عنوان آند عمل میکند و تمایل دارد الکترونهای خود را از دست بدهد. از طرف دیگر، سکه مسی به عنوان کاتد عمل میکند و الکترونها را دریافت میکند. این اختلاف پتانسیل بین دو فلز باعث میشود الکترونها از طریق سیمها از روی به مس جریان پیدا کنند. در این واکنش انرژی شیمیایی به انرژی الکتریکی تبدیل می شود. این جریان الکترونها همان برق یا جریان الکتریکی است که میتواند لامپ LED را روشن کند. بنابراین، ترکیب شیمیایی لیمو و تفاوت خواص فلزات به کار رفته، منجر به تولید برق در این آزمایش ساده و جالب میشود. برای دریافت اطلاعات بیشتر در مورد جز اصلی این واکنش یعنی اسید سیتریک می توانید به صفحه زیر مراجعه کنید.
https://bismoot.com/%D8%A7%D8%B3%DB%8C%D8%AF-%D8%B3%DB%8C%D8%AA%D8%B1%DB%8C%DA%A9/

آموزش انجام آزمایش باتری لیمویی
مواد مورد نیاز برای ساخت باتری لیمویی
برای انجام این آزمایش ساده و جذاب، به موارد زیر نیاز دارید:
- • لیمو: ۴ عدد (میتوانید تعداد بیشتری هم استفاده کنید)
- • میخ گالوانیزه (روکش روی): ۴ عدد
- • سکه یا ورق مسی: ۴ عدد
- • سیم مسی نازک: به مقدار لازم برای اتصالها
- • لامپ LED کوچک یا ولتمتر: برای مشاهده یا اندازهگیری ولتاژ
- • گیره سوسماری (اختیاری): برای اتصال راحتتر سیمها
مراحل انجام آزمایش
مرحله اول: آمادهسازی لیموها
ابتدا باید لیموها را برای آزمایش آماده کنیم. هر لیمو را به آرامی روی میز بغلتانید و با دست کمی فشار دهید تا نرم شود. این کار باعث میشود آب لیمو درون آن به حرکت درآید و تماس بهتری با الکترودها داشته باشد. مراقب باشید که پوست لیمو پاره نشود؛
مرحله دوم: قرار دادن الکترودها در لیموها
حالا باید میخ گالوانیزه و سکه مسی را در لیموها قرار دهیم. یک میخ گالوانیزه را در یک سمت لیمو فرو کنید؛ به طوری که حدود نیمی از آن داخل لیمو باشد. سپس در سمت مقابل همان لیمو، یک سکه یا ورق مسی را وارد کنید. دقت کنید که میخ و مس داخل لیمو با یکدیگر تماس نداشته باشند، زیرا این کار باعث اتصال کوتاه و عدم کارکرد باتری میشود.
مرحله سوم: اتصال لیموها به یکدیگر
در این مرحله، باید لیموها را به صورت سری به یکدیگر متصل کنیم تا ولتاژ بیشتری تولید شود. با استفاده از سیم مسی، الکترودهای لیموها را به هم وصل کنید. سیمی را به سکه مسی لیمو اول متصل کرده و سر دیگر آن را به میخ گالوانیزه لیمو دوم وصل کنید. این روند را ادامه دهید؛ یعنی سکه مسی لیمو دوم را به میخ لیمو سوم و به همین ترتیب تا آخرین لیمو.
مرحله چهارم: اتصال به لامپ LED یا ولتمتر
پس از اتصال لیموها به یکدیگر، نوبت به اتصال باتری لیمویی به دستگاه اندازهگیری یا لامپ میرسد. یک سیم را به میخ گالوانیزه لیمو اول وصل کنید؛ این سیم به عنوان قطب منفی عمل میکند. سیم دیگری را به سکه مسی لیمو آخر متصل کنید؛ این سیم قطب مثبت باتری شماست. سرهای آزاد این دو سیم را به پایههای لامپ LED یا ولتمتر وصل کنید. اگر از لامپ LED استفاده میکنید و روشن نشد، جای سیمها را عوض کنید، زیرا LED به جهت جریان حساس است.
مرحله پنجم: مشاهده نتایج
اکنون باتری لیمویی شما آماده است و میتوانید نتایج را مشاهده کنید. اگر همه اتصالات به درستی انجام شده باشد، لامپ LED باید روشن شود. ممکن است نور لامپ کم باشد، بنابراین در محیطی با نور کمتر آزمایش کنید تا بهتر متوجه روشن شدن آن شوید. اگر از ولتمتر استفاده میکنید، عددی را مشاهده خواهید کرد که نشاندهنده ولتاژ تولید شده است. معمولاً هر لیمو حدود ۰.۹ ولت تولید میکند، بنابراین با چهار لیمو باید حدود ۳.۶ ولت داشته باشید.

مرحله ششم: رفع اشکالات احتمالی
اگر لامپ روشن نشد یا ولتاژ قابل قبولی نداشتید، ممکن است به دلایل زیر باشد:
- • اتصالات شل یا ناقص: اطمینان حاصل کنید که سیمها به خوبی به الکترودها متصل شدهاند و تماس الکتریکی مناسبی دارند.
- • تعداد لیموها کم است: برای افزایش ولتاژ میتوانید تعداد لیموها را بیشتر کنید.
- • لامپ LED یا ولتمتر مشکل دارد: از سالم بودن دستگاههایی که استفاده میکنید، مطمئن شوید.
- • تماس میخ و مس داخل لیمو: بررسی کنید که میخ و سکه مسی در داخل لیمو با هم تماس نداشته باشند.
آزمایش باتری لیمو: مبنای تولید باتری های امروزی
باتریهایی مانند سلول دانیل، باتریهای آلکالاین، باتریهای سرب-اسیدی (که در خودروها استفاده میشوند) و باتریهای لیتیوم-یونی (مورد استفاده در دستگاههای الکترونیکی همراه) همگی بر اساس تبدیل انرژی شیمیایی به انرژی الکتریکی از طریق واکنشهای اکسایش و کاهش عمل میکنند. در این باتریها، مانند آزمایش لیمو، دو فلز مختلف به عنوان الکترود در حضور یک الکترولیت با هم واکنش میدهند. هرچند مواد و طراحی این باتریها پیچیدهتر و پیشرفتهتر است، اما اصول پایهای آنها مشابه همان چیزی است که در باتری لیمویی مشاهده میشود.
نکات جالب درباره باتری لیمویی
- ۱- لیمو تنها واسطهای برای واکنش است، نه منبع الکترونها: در باتری لیمویی، اسید سیتریک موجود در لیمو به عنوان الکترولیت عمل میکند و محیطی را فراهم میکند که یونها میتوانند در آن حرکت کنند. اما منبع اصلی الکترونها در واقع فلزات به کار رفته (روی و مس) هستند، نه خود لیمو.
- ۲- امکان استفاده از میوهها و مواد دیگر: این آزمایش محدود به لیمو نیست. میتوانید از سیبزمینی، پرتقال، سیب یا حتی نوشیدنیهای ورزشی به عنوان الکترولیت استفاده کنید. هر مادهای که دارای الکترولیت باشد میتواند در این نوع باتریها به کار رود.
- ۳- تأثیر انتخاب فلزات مختلف: استفاده از فلزات متفاوت به عنوان الکترود میتواند ولتاژ و جریان تولیدی را تغییر دهد. مثلاً جایگزینی میخ روی با نوار منیزیم میتواند ولتاژ بالاتری ایجاد کند، زیرا منیزیم تمایل بیشتری به از دست دادن الکترون دارد.
- ۴- باتری لیمویی نمونهای از خوردگی گالوانیکی: واکنشهای رخ داده در این آزمایش مشابه فرآیند خوردگی گالوانیکی است که در آن یک فلز در حضور الکترولیت و فلز دیگر اکسید میشود. این مفهوم در مهندسی مواد و حفاظت از سازهها بسیار مهم است.
- ۵- محدودیتهای جریان الکتریکی: به دلیل مقاومت داخلی بالا در باتری لیمویی، جریان تولیدی کم است. این نشان میدهد که ولتاژ بالا لزوماً به معنای توان یا جریان بالا نیست و برای تأمین انرژی دستگاههای پرمصرف کافی نخواهد بود.
جمع بندی
آزمایش باتری لیمویی یک آزمایش ساده، جذاب و آموزنده است که به ما امکان میدهد تا اصول اساسی الکتروشیمی را به صورت عملی تجربه کنیم. با استفاده از مواد معمولی مانند لیمو، میخ گالوانیزه و سکه مسی، میتوانیم انرژی شیمیایی را به انرژی الکتریکی تبدیل کرده و یک لامپ LED را روشن کنیم. این واکنش نشان میدهد که چگونه تفاوت خواص فلزات و حضور یک الکترولیت میتواند به تولید برق منجر شود.
بفرست برای دوستات
source